2021年11月3日,来自日本横滨研究所的Sidonia Fagarasan团队揭示了免疫细胞的功能,发现免疫B细胞会分泌GABA——一种最广为人知的神经递质分子,可以调节针对肿瘤的免疫反应,该研究为开发新方法以增强抗癌疗法提供了理论基础。

研究者在小鼠通过免疫接种暴露于外源蛋白质后,检测了小鼠淋巴结(一种富含免疫细胞的组织)中的代谢物分子变化。随后,将免疫部位附近淋巴结中的代谢物与小鼠身体另一侧淋巴结中的代谢物进行了比较,发现免疫接种部位附近的淋巴结中大约有200种代谢物水平呈现显著差异,特别是与谷氨酸途径系统激活相关的代谢物。
研究者使用缺乏B细胞和T细胞的小鼠重复了这个实验,并将这些动物与不缺乏免疫细胞的小鼠进行比较,发现免疫后主要的代谢变化发生在B细胞(产生抗体的细胞)中。令人惊讶的是,免疫接种后上调的主要代谢物是γ-氨基丁酸 (GABA),以前不知道它是由B细胞产生的。GABA作为大脑中的神经递质,在神经发育中起着关键作用,它与某些神经系统疾病有关,并通过谷氨酸途径产生。
为了探索免疫细胞中GABA的合成,研究者检测了来自小鼠和人类的B细胞,使用与细胞上关键防御受体—B细胞抗原受体(BCR)结合的抗体 anti-IgM在体外激活细胞, 然后将细胞暴露于被同位素标记的谷氨酰胺中,并追踪其代谢。正如预期的那样,谷氨酰胺转化为谷氨酸,这种分子随后被谷氨酸脱羧酶(GAD65和GAD67)转化为GABA。B细胞中标记的GABA水平在细胞活化后增加,并且 B 细胞可以分泌标记的GABA。而且,研究发现T 细胞不表达 GAD65或GAD67,而B细胞表达GAD67。总之,这些结果表明,免疫刺激诱导下小鼠和人类 B 细胞能合成和分泌 GABA(图 1)。

图1 | B 细胞释放 的GABA 抑制免疫细胞的抗肿瘤反应
此前研究自身免疫的研究发现T细胞可表达A型 GABA (GABAA) 受体。通过GABA结合激活这些受体会打开受体中的氯离子通道,从而导致炎症类型的T细胞——辅助CD4 T细胞和杀伤性CD8 T细胞被抑制,已知这两种T细胞类型都是自身免疫性疾病组织损伤的关键因素。GABAA受体的激活还会增加一种称为调节性T细胞的数量,从而抑制炎症。免疫系统的其他细胞,被称为抗原呈递细胞,也表达有GABAA受体,它们包括巨噬细胞、树突细胞和NK细胞,它们通过向 T细胞呈递抗原的外来蛋白质片段来帮助防御。这些抗原呈递细胞上GABAA受体的激活降低了它们的促炎特性。一些实验室利用激活GABAA受体的分子的抗炎作用来抑制I型糖尿病、多发性硬化症和类风湿性关节炎等疾病小鼠模型中的自身免疫,以及应对由感染小鼠的冠状病毒引起的严重疾病。
GABA 通过阻止神经元信号传递所需的神经元去极化过程来抑制神经传递。相比之下,T 细胞GABAA受体的激活导致去极化,从而限制钙进入细胞并减少细胞复制和炎症活动。在此前研究的基础上,该研究通过体外实验,发现一种称为muscimol的药物可特异性地激活 GABAA受体,并限制了 CD8 T 细胞的激活和增殖,而一种称为picrotoxin的GABAA受体抑制剂则可提高小鼠和人类CD8 T细胞中的钙水平(图2d,e)。
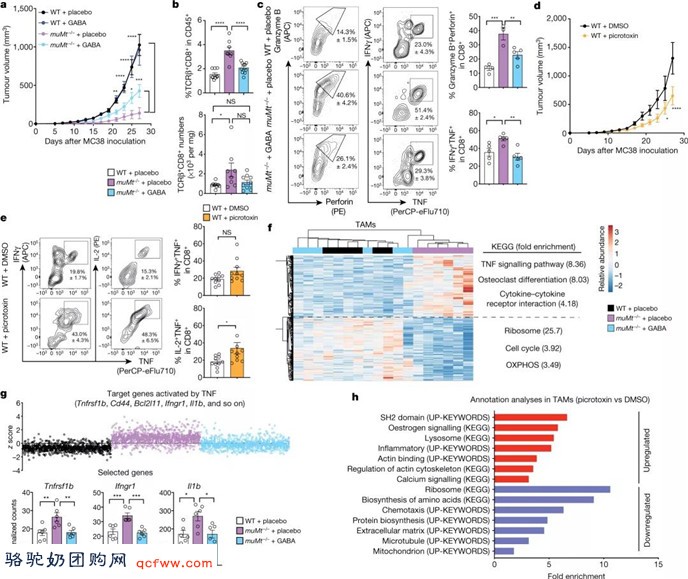
图2丨B 细胞通过 GABA 限制抗肿瘤反应
研究者探索了B细胞分泌的GABA是否影响体内抗肿瘤反应,专注于结肠癌,并研究了这种肿瘤的小鼠模型,其中缺乏B细胞的小鼠的癌症生长减少,这一发现表明B细胞衍生因子限制了该模型中的抗肿瘤反应。与对照动物(具有 B细胞的携带肿瘤的野生型小鼠)中的肿瘤相比,B细胞缺陷小鼠的肿瘤具有更多的肿瘤浸润CD8 T细胞。此外,与对照小鼠中的此类T细胞相比,B细胞缺陷小鼠中的CD8 T细胞具有更高水平的与细胞杀伤能力(细胞毒性分子)和炎症相关的分子(图3a, b)。
GABA给药对野生型小鼠的肿瘤生长没有影响,而在B细胞缺陷小鼠中,它使肿瘤的大小增加到更接近野生型小鼠中发现的肿瘤的大小。这种GABA治疗降低了肿瘤浸润CD8 T细胞的数量,并减少了B细胞缺陷小鼠中细胞毒性和炎症分子的产生。此外,在给予GABAA受体特异性抑制剂的对照动物中,肿瘤大小减小,肿瘤浸润CD8 T细胞的细胞毒性增加。这些发现表明B细胞分泌的 GABA在体内抑制了杀伤肿瘤细胞的CD8 T细胞的反应(图3c, d)。
对肿瘤的免疫反应有时无法抑制癌症的生长,因为肿瘤中的炎症性抗癌免疫反应受到抑制。肿瘤相关巨噬细胞通常在这种抑制中起作用。继续使用结肠癌小鼠模型,研究者观察到与对照小鼠中的此类巨噬细胞相比,B细胞缺陷小鼠中的肿瘤相关巨噬细胞表现出增强的促炎途径表达。如果B细胞缺陷小鼠接受 GABA,这些途径就会减少。此外,从接受GABAA受体抑制剂的野生型小鼠中分离的肿瘤相关巨噬细胞上,显示出与钙信号传导和炎症细胞因子相关的基因表达增加。GABA 还增强了具有抗炎特性的巨噬细胞的分化和数量。因此,B细胞分泌的GABA可以将肿瘤相关巨噬细胞和CD8 T细胞的抗肿瘤反应转向较少的炎症活性(图3e)。
最后,研究者构建了不表达GAD67的B细胞,并因此缺乏GABA的小鼠。至关重要的是,移植到这些小鼠体内的肿瘤细胞显示出生长减少,并且与表达GAD67的B细胞的对照动物中的肿瘤细胞相比,这些动物的肿瘤浸润CD8 T细胞具有更大的细胞毒性和更强的促炎特性(图3f,g)。

图3丨B 细胞来源的GABA分化抗炎巨噬细胞,促进肿瘤生长
总结
该研究证明了B细胞分泌GABA的惊人发现,GABA可以通过其GABAA 受体促进抗炎巨噬细胞并抑制CD8 T细胞的抗肿瘤反应,此结果可能会有利于推动进一步的临床前(动物)和临床研究。
需要考虑的一个问题是,广泛用于各种保健品中的GABA是否会对人类产生不利影响。研究者发现GABA给药增加了B细胞缺陷小鼠的肿瘤大小,更类似于野生型小鼠的肿瘤大小,但不影响野生型小鼠的肿瘤大小。目前,尚未报告补充剂中GABA的消耗或使用专门增强GABAA受体活性的药物(例如用于治疗焦虑症的阿普唑仑)与肿瘤质量的变化之间存在关联,但是应该检测这种可能性。阐明B细胞分泌的GABA调节抗肿瘤反应的肿瘤类型,以及这种调节是否发生在骨髓、淋巴结和肿瘤微环境中将是十分有趣的一项研究。
未来研究的另一个领域将是研究B细胞分泌的GABA对促炎CD4 T细胞的影响,以及调节性T细胞的反应是否在肿瘤和因自身免疫疾病而发炎的组织中得到增强。此外,由于GABA具有作为治疗方法的潜力,因此需要进一步研究免疫细胞GABAA受体的药理学抑制肿瘤的特性,,以及探索经过修饰的GABAA受体缺陷的T细胞或抗原呈递细胞对肿瘤细胞的攻击能力(即过继性T细胞免疫治疗),从而为临床试验奠定基础。
参考文献
1.Zhang, B. et al. Nature https://doi.org/10.1038/s41586-021-04082-1 (2021).
2.Deidda, G., Bozarth, I. F. & Cancedda, L. Front. Cell. Neurosci. 8, 119 (2014).
3.Mendu, S. K. et al. Mol. Immunol. 48, 399–407 (2011).
4.Tian, J., Song, M. & Kaufman, D. L. Sci. Rep. 11, 5402 (2021).
5.Tian, J. et al. ImmunoHorizons 3, 498–510 (2019).
特别说明:此文源于网络,转载是希望更多关注此类资讯的朋友更加方便了解,如有侵权请联系删除,邮箱:197747@qq.com